
2018年12月31日,清华大学施一公教授研究团队于顶级学术期刊《自然》(Nature)发表阿尔兹海默症关键蛋白作用机制的研究成果,是我国2018年的最后一篇Nature文章,也是生命科学领域的收官之作。
今年1月10日,施一公教授团队在另一顶级学术期刊《科学》(Science)发表了该领域的又一重要研究成果,拉开了2019年我国生命科学领域研究的序幕。

阿尔茨海默症(AD,俗称老年痴呆症),一种常见的神经退行性疾病,会导致进行性脑萎缩和记忆丧失,从而造成痴呆、残疾,甚至死亡。这一世界性难题的疾病目前发病机制仍不明确, 但在患者脑中看得到的现象是,由一些错误折叠的蛋白组成的淀粉样蛋白斑块不断产生和聚集。
西湖大学校长、清华大学生命学院、结构生物学高精尖创新中心施一公教授领导的研究团队正在将其始于十几年前的阿尔茨海默症研究进一步推进。北京时间1月11日凌晨,施一公研究团队在《科学》(Science)发表最新研究成果:《人源γ-分泌酶底物淀粉样前体蛋白的识别》(Recognition of the amyloid precursor protein by human γ-secretase)。论文报道了人源γ-分泌酶分别结合底物淀粉样前体蛋白(APP)的冷冻电镜结构,分辨率高达2.6埃(1埃=0.1纳米)。
清除淀粉样蛋白是治疗阿尔茨海默症的主流策略,而γ-分泌酶被认为是导致阿尔兹海默氏病关键因素之一。其是细胞膜上的一个蛋白酶体,或者更通俗地形容为“垃圾粉碎机”。它的主要作用是降解细胞膜上的一些废物蛋白,把它降解成小的片段,让人体再吸收、再利用。施一公等人认为,淀粉样斑块是由γ-分泌酶异常切割淀粉样前体蛋白APP而产生过量易聚集的Aβ42肽所致。
数据显示,在65岁以上人群中,阿尔茨海默症发病率高达10%;在85岁以上人群中,发病率达30-50%;中国目前阿尔茨海默症人群高达500万,约占世界患者总数的四分之一。
抑制γ-分泌酶策略为何失败?
对于阿尔茨海默症,比较主流的是“β淀粉样蛋白假说”,该假说认为淀粉样蛋白寡聚物直接导致阿尔茨海默症的发展。如果这一假说成立,抑制γ-分泌酶会是一种具有潜力的治疗策略。
患者脑部聚集的淀粉样蛋白斑块中最主要的成分是β淀粉蛋白短肽(Aβs),β淀粉蛋白短肽则是由β淀粉样前体蛋白(amyloid precursor protein,APP)水解而来。I型跨膜蛋白APP在跨膜分泌过程中一般有两条水解途径,经α-分泌酶或β- 分泌酶水解形成APP-C83(含83个氨基酸残基的片段)或APP-99(含99 个氨基酸残基的片段)。
其中,经α-分泌酶水解途径,为非淀粉样蛋白形成途径,而经β- 分泌酶水解途径(随后有γ-分泌酶参与)则会最终形成淀粉样蛋白。此前的研究认为,Aβ42和Aβ40最易形成和聚集淀粉样蛋白。
虽然“β淀粉样蛋白假说”至今没有得到证实,但各大制药巨头早已纷纷基于此假说开发新药。不幸的是,截至目前,抑制γ-分泌酶策略在临床上尚未看到有益于阿尔茨海默症的任何疗效,相反,产生了严重的副作用。
美国辉瑞、默克公司、礼来公司此前纷纷宣布“罢手”。 这些公司不愿意继续“烧钱”,礼来公司仅在开发针对β淀粉样蛋白的单抗新药Solanezumab所花费的资金是90亿美金。
论文中指出,失败的背后或许是,抑制γ-分泌酶的同时也抑制了Notch的水解。
Notch是一种重要的信号蛋白。论文中提到,除了淀粉样前体蛋白APP, Notch也是γ-分泌酶的底物。而Notch一旦被异常切割会导致发育的异常,与一些包括T细胞急性淋巴细胞白血病在内的癌症发病也有重要联系。
“对γ-分泌酶结合底物机制研究的缺失是造成失败的原因之一。”施一公谈到,这些药物旨在降低γ-分泌酶这把大剪刀对淀粉样蛋白的切割,从而减少淀粉样沉淀来治疗老年痴呆症,而理想的情况是,这台蛋白质机器只减少对淀粉样蛋白的加工,而不影响处理其他的原材料。“为此,获得γ-分泌酶与底物Notch以及前体蛋白APP复合物的结构,对研究γ-分泌酶的底物识别酶切机理和设计以γ-分泌酶为靶标的特异性药物,具有极大科学意义和潜在应用价值。”
开发特异性抑制剂或是正确方向
有没有一种抑制剂,只会抑制γ-分泌酶切割水解淀粉样前体蛋白APP,而不影响Notch?施一公团队为此从更它们各自复合物的精细结构入手。
人源γ-分泌酶由四个跨膜蛋白亚基组成,分别为早老素presenilin(PS)、Pen-2、APH-1和nicastrin。早老素PS是执行酶活功能的膜整合蛋白酶活性亚基,有两种亚型PS1和PS2。其中,在PS1上已鉴定出超过200种和阿尔茨海默症相关的突变,大多数会导致Aβ42或Aβ40比例上升。
这篇论文中报道了γ-分泌酶和β淀粉样前体蛋白APP的复合物的冷冻电镜结构,结构分辨率高达2.6埃(1埃=0.1纳米)。
研究结果显示,γ-分泌酶与底物β淀粉样前体蛋白APP复合物的结构中,PS1和底物形成β-折叠片对γ-分泌酶的蛋白水解活性至关重要。在跨膜区靠近细胞内的一侧,PS1通过发生较大的构象变化,与底物的胞内段形成稳定的β-折叠片结构,为稳定底物提供了保证。在此状态下,底物自身的螺旋结构解开一部分,暴露出被加工的位置。
研究团队提出了γ-分泌酶结合底物β淀粉样前体蛋白APP并依次进行多步酶切的机理:底物的跨膜螺旋随着加工的进行逐步解旋,被再次加工。
值得一提的是,此前的2018年12月31日,施一公等人已在《自然》(Nature)发表论文,解析了人源γ-分泌酶结合底物Notch的冷冻电镜结构,分辨率高达2.7埃(1埃=0.1纳米),揭示结合底物Notch后γ-分泌酶的构象变化。
研究团队此番在论文中指出,相较而言,γ-分泌酶和底物Notch的复合物显示出截然不同的特点。
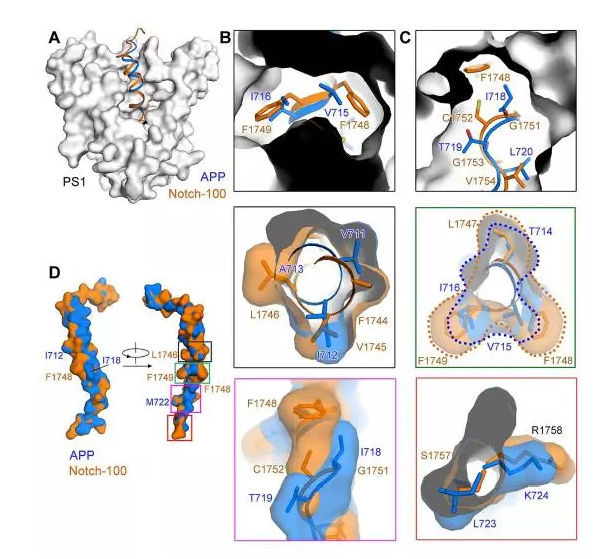
研究团队通过系统性地在结构当中比较Notch与β淀粉样前体蛋白APP部分被加工区域的区别,揭示了研发这种特异性抑制剂的潜在的结合位点。有很多与阿尔兹海默症相关的突变集中在PS1和APP上,这些突变可能会导致对APP的异常切割。其中一些会发生多种突变的位点,大多就集中在γ-分泌酶识别APP的位置。研究团队通过对结构的详细分析,分类讨论了这些突变可能影响底物结合的机理。
研究团队认为,这或许会开发底物特异性的抑制剂带来启发。未来可以开发特异地抑制β淀粉样前体蛋白APP的加工而不影响Notch加工的药物,靶向治疗阿尔兹海默症且不导致副作用。据了解,研究团队目前正在研究γ-分泌酶与特异抑制剂的相互作用。
十年求索:愈加清晰的研究视野
值得注意的是,施一公团队对阿尔茨海默症的研究实际上已超过了10年。2012年,施一公团队在《自然》杂志首次报道了人源早老素蛋白PS在古细菌Methanoculleus marisnigri JR1中同源蛋白PSH的晶体结构。
施一公教授2006年在清华大学建设实验室之初,就将揭示阿尔兹海默症的发病机理作为重点研究方向。此次发表的两篇研究成果是研究团队长期以来在该领域持续发力的重要结晶。在此之前,施一公教授及其所带领的团队在该领域不断突破,发表了一系列重要研究成果:
2012年12月,施一公研究组在《自然》(Nature)报道PS1细菌同源蛋白PSH的晶体结构,并根据同源性首次构建了PS1的结构模型,揭示了PS1的结构折叠,并在结构上初步分析了在阿尔兹海默症病人中发现的PS1突变位点。
2014年6月,施一公研究组与英国MRC分子生物学实验室白晓晨博士等合作在《自然》(Nature)报道了分辨率为4.5埃的γ-分泌酶复合物电镜结构,观察到了其跨膜区域呈马蹄形排布的结构。
2014年9月,施一公研究组在《美国科学院院刊》(PNAS)发表文章,报道了其中一个亚基Nicastrin同源蛋白胞外结构域的高分辨率晶体结构,推测了Nicastrin在底物招募过程中可能的机制,并且根据同源性构建了人源Nicastrin 胞外结构域的结构,结合该结构与此前解析的PSH晶体结构和4.5埃分辨率电镜结构,他们在γ-分泌酶跨膜区辨认出了PS1,并进一步推测了该复合物近20个跨膜螺旋的组装模式。
2015年3月,施一公研究组在《美国科学院院刊》(PNAS)发表论文,报道PS1的细菌同源蛋白PSH具有与γ-分泌酶类似的底物切割活性,并且其酶活也受到γ-分泌酶小分子抑制剂的抑制,并解析了该抑制剂与PSH的复合物结构,揭示了其抑制位点,从而使得PSH可以作为一个研究成本相对低廉的替代品来进行γ-分泌酶调控小分子的初步筛选。
2015年4月,施一公研究组在《美国科学院院刊》(PNAS)发表论文,报道人源γ-分泌酶4.3埃的冷冻电镜三维结构。与一年之前的4.5埃结构相比,尽管分辨率只提高0.2埃,但是跨膜区密度质量有了极大提高。此外他们在PS1的N端连接T4-溶菌酶蛋白,从而准确定位出PS1的第一个跨膜螺旋,并在此基础上判断出四个亚基,验证了在2014年PNAS文章中推测的组装方式。此外,他们利用性质非常缓和的去污剂制备样品,证明电镜观察到的结构并未因蛋白纯化和冷冻制备而受到影响。这个结构也是清华大学电镜平台的K2电子探测相机自2014年暑期正常运转之后解析出的最小分子量的结构。
2015年8月18日,施一公研究组在《自然》(Nature)在线发表了题为《人源γ-分泌酶的原子分辨率结构》(An Atomic Structure of Human γ-secretase)的文章,报道了分辨率高达3.4埃的人体γ-分泌酶的电镜结构,并且基于结构分析研究了γ-分泌酶致病突变体的功能,为理解γ-分泌酶的工作机制以及阿尔兹海默症的发病机理提供了重要基础。
2017年,施一公研究组于《美国科学院院刊》(PNAS)发表两篇文章,对γ-分泌酶上疾病相关突变切割APP的性质和机理进行了研究。
版权声明
本文来源:澎湃新闻、清华研读间
了解更多扫描二维码
